- Forschung
- Karriere
- Aktuelles
- Institut
- Durchsuchen
- Spachumstellung
- Leichte Sprache

„”
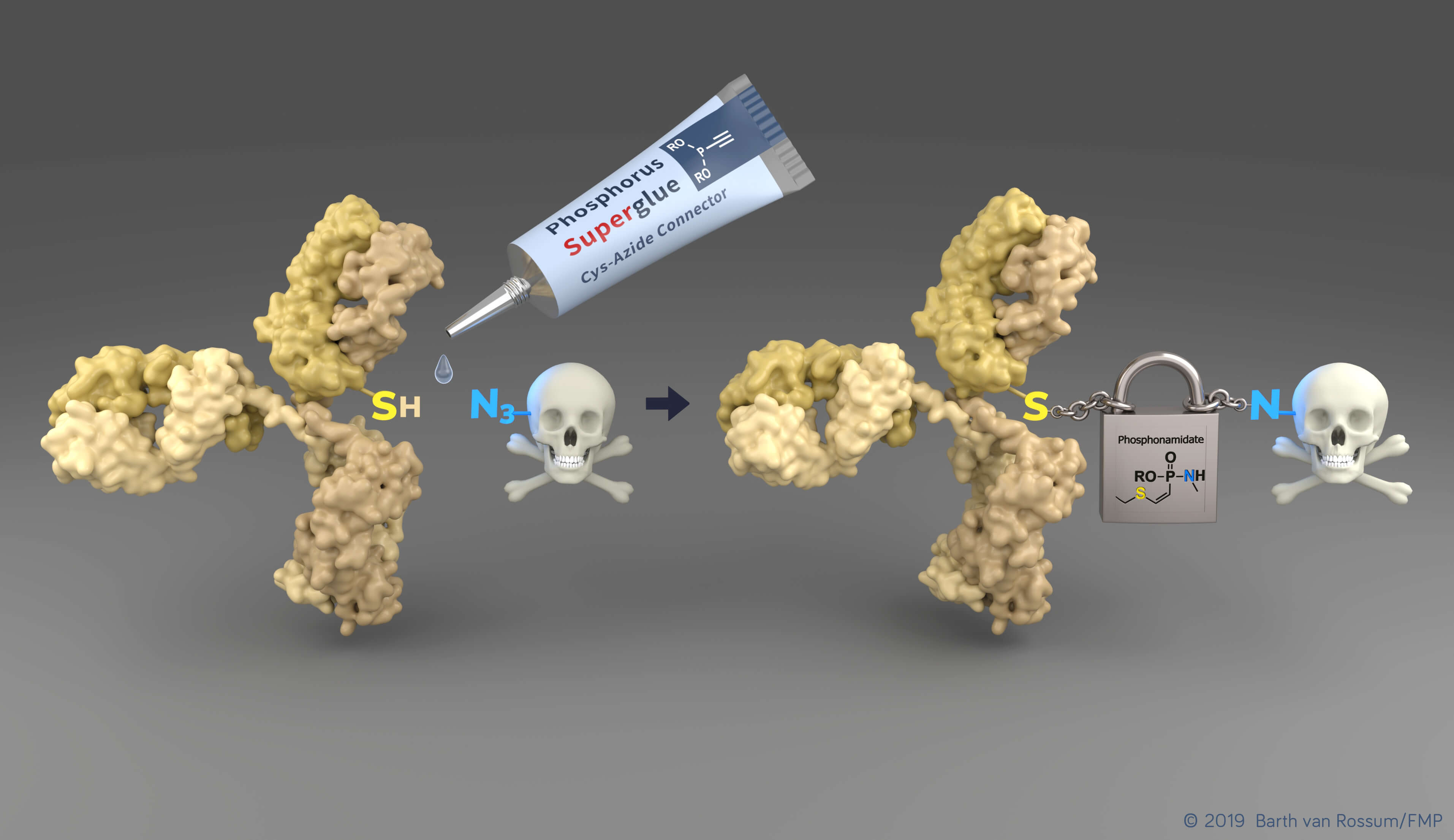
Mithilfe der neu entwickelten Technologie können Cysteine (SH) von Tumor-erkennenden Antikörpern (gelb) einfach mit toxischen Wirkstoffmolekülen verbunden werden. Die entstehende Bindung ist während der Zirkulation im Blut sehr stabil und ermöglicht so einen sicheren Transport zum Tumor. Visualisierung: Barth van Rossum (FMP) © Barth van Rossum, FMP
Die klassische Chemotherapie zur Behandlung von Krebserkrankungen beruht auf toxischen Substanzen, die bei schnell teilenden Zellen besonders wirksam sind. Da aber auch gesundes Gewebe auf Zellteilung angewiesen ist, geht die Behandlung mit Chemotherapeutika oft mit starken Nebenwirkungen einher. Eine Dosis, die ausreicht, um den Tumor vollständig aufzulösen, wäre in vielen Fällen zu toxisch, um sie einer erkrankten Person zu verabreichen. Mit moderneren Herangehensweisen ist es heute möglich, Wirkstoffe zielgerichtet im Körper zu transportieren, zum Beispiel indem ein Wirkstoff (Drug) mit einem Antikörper verknüpft wird, der durch Veränderungen auf der Zelloberfläche Krebszellen von gesundem Gewebe unterscheiden kann. Fünf solcher Antibody-Drug-Conjugates (ADCs) sind bereits auf dem Markt.
Diese ADCs verlieren jedoch ihre „toxische Ladung“ zu einem großen Teil schon auf dem Weg zur Krebszelle. Die Substanzen werden im Blutkreislauf freigesetzt, und es können gefährliche Nebenwirkungen auftreten. Wünschenswert wäre also eine stabile Verknüpfung zwischen Wirkstoff und Antikörper. Hier setzten die Forschenden – ein Team um Professor Christian Hackenberger vom FMP und Professor Heinrich Leonhardt vom Biozentrum der LMU – an. Ihre Ergebnisse sind in der renommierten Fachzeitschrift Angewandte Chemie erschienen: In gleich zwei aufeinanderfolgenden Artikeln werden die Methodenentwicklung sowie deren Anwendung auf zielgerichteten Wirkstofftransport dargestellt.
Die neuen Wirkstofftransporter ermöglichen geringere Dosen und Nebenwirkungen
„Wir haben eine neuartige Technologie entwickelt, die es ermöglicht, natürliche Proteine und Antikörper mit komplexen Molekülen wie Fluoreszenzfarbstoffen oder medizinischen Wirkstoffen zu verknüpfen, und das einfacher und stabiler als je zuvor“, berichtet Marc-André Kasper, Forscher in der Gruppe von Christian Hackenberger. Dabei stießen die Forschenden auf die herausragenden Eigenschaften ungesättigter Phosphor-(V)-Verbindungen und machten sich diese zunutze. Diese Phosphonamidate verbinden eine gewünschte Modifikation – zum Beispiel einen krebsbekämpfenden Wirkstoff – ausschließlich mit der Aminosäure Cystein in einem Protein bzw. Antikörper. Da es sich bei Cystein um eine sehr seltene natürliche Aminosäure handelt, kann die Anzahl an Modifikationen pro Protein sehr gut kontrolliert werden, was für die Herstellung von Wirkstoffkonjugaten unerlässlich ist. Außerdem lassen sich Phosphonamidate sehr einfach auch in komplexe chemische Verbindungen einbauen. „Die größte Errungenschaft der neuen Methode ist allerdings, dass die so entstandene Bindung auch während der Zirkulation im Blut stabil ist“, so Marc-André Kasper. Die heute verfügbaren ADCs können dies nicht leisten.
Um die Anwendung für den zielgerichteten Wirkstofftransport zu testen, verglichen die Forschenden ihre Technologie direkt mit dem zugelassenen ADC Adcetris®. Das Präparat wurde so exakt wie möglich mit gleichem Antikörper und Wirkstoff nachgebaut mit dem einzigen Unterschied, dass die neuartige Phosphonamidat-Verknüpfung zum Einsatz kam. Bei der Anwendung in Blutserum konnten die Forschenden beobachten, dass mit dem modifizierten Präparat über Tage hinweg deutlich weniger Wirkstoff verloren geht. Sie setzten die neue Technologie darüber hinaus im Versuch mit Mäusen zur Bekämpfung eines Hodgkin-Lymphoms ein.
Das Präparat erwies sich dabei im Vergleich zum herkömmlichen Medikament als wirksamer. „Aus unseren Ergebnissen schließen wir, dass Phosphonamidat-verknüpfte Wirkstofftransporter in geringeren Dosen verabreicht und Nebenwirkungen weiter verringert werden können. Die Technologie hat somit großes Potenzial, gängige Methoden zu ersetzen, um zukünftig wirksamere und sichere ADCs zu entwickeln“, sagt FMP-Gruppenleiter Christian Hackenberger.
Im nächsten Schritt möchten sich die Forschungsgruppen weiter mit der Entwicklung von ADCs auf der Basis von Phosphonamidaten befassen. Derzeit laufen bereits präklinische Studien, die für eine Anwendung bei erkrankten Menschen unerlässlich sind. Das vielversprechende Start-up Tubulis, das im letzten Jahr mit dem Leibniz-Gründerpreis ausgezeichnet wurde, fungiert dabei als Plattform für die Weiterentwicklung bis zur Marktreife.
Publikationen
Marc-André Kasper, Maria Glanz, Andreas Stengl, Martin Penkert, Simon Klenk, Tom Sauer, Dominik Schumacher, Jonas Helma, Eberhard Krause, M. Cristina Cardoso, Heinrich Leonhardt, Christian P. R. Hackenberger, Cysteine‐Selective Phosphonamidate Electrophiles for Modular Protein Bioconjugations, Angew. Chem. Int. Ed. 2019 doi:10.1002/anie.201814715
Marc-André Kasper, Andreas Stengl, Philipp Ochtrop, Marcus Gerlach, Tina Stoschek, Dominik Schumacher, Jonas Helma, Martin Penkert, Eberhard Krause, Heinrich Leonhardt, Christian P. R. Hackenberger, Ethynylphosphonamidates for the rapid and cysteine selective generation of efficacious Antibody-Drug-Conjugates, Angew. Chem. Int. Ed. 2019 doi:10.1002/anie.201904193